Bài dịch: Giải Nobel lĩnh vực hóa học trao cho CRISPR, một công cụ chỉnh sửa gen
Có thể nói CRISPR/Cas9 là một trong những phát kiến vĩ đại của thế kỷ 21. Nó mở ra hàng loạt ứng dụng trong y học và nông nghiệp. Chính...
Có thể nói CRISPR/Cas9 là một trong những phát kiến vĩ đại của thế kỷ 21. Nó mở ra hàng loạt ứng dụng trong y học và nông nghiệp. Chính vì thế mà mới chỉ có 8 năm kể từ khi được công bố cho đến nay, nó đã được giải Nobel gọi tên. Dưới đây là bài dịch của tác giả Tina Hesman Saey.
Jenifer Doudna và Emmanuelle Charpentier đã biến cơ chế phòng vệ của vi khuẩn thành một công cụ mạnh nhất trong lĩnh vực di truyền. Vì những nỗ lực đó, họ đã vừa mới nhận giải Nobel lĩnh vực hóa học năm 2020.
Wittung-Stafshede phát biểu tại một cuộc họp báo vào ngày 7 tháng 10 tại Stockholm trước Viện Hàn lâm Khoa học Hoàng gia Thụy Điển. Giải thưởng đã được công bố tại sự kiện này. "Chỉ có trí tưởng tượng mới đặt ra giới hạn cho những lĩnh vực mà công cụ hóa học này… có thể áp dụng được trong tương lai," bà nói. "Có lẽ ước mơ chữa khỏi bệnh do di truyền sẽ trở thành hiện thực." Tuy nhiên, bà cảnh báo rằng đạo đức và luật pháp nên được sử dụng để quyết định lĩnh vực nào và cách thức để áp dụng một công cụ mạnh đến như vậy.
Luis Echegoyen cho biết thêm, chiến thắng này là "rất được mong đợi". Ông là nhà hóa học tại Đại học Texas ở El Paso và là chủ tịch của Hiệp hội Hóa học Hoa Kỳ. Mặc dù thời gian từ khi khám phá ra đến khi nhận giải thưởng Nobel thường lâu hơn nhiều, nhưng giải thưởng này cho CRISPR đã "quá hạn", ông nói. Doudna và Charpentier sẽ chia nhau giải thưởng 10 triệu kronor Thụy Điển, tương đương khoảng 1.1 triệu USD.

Học tập từ những vi khuẩn
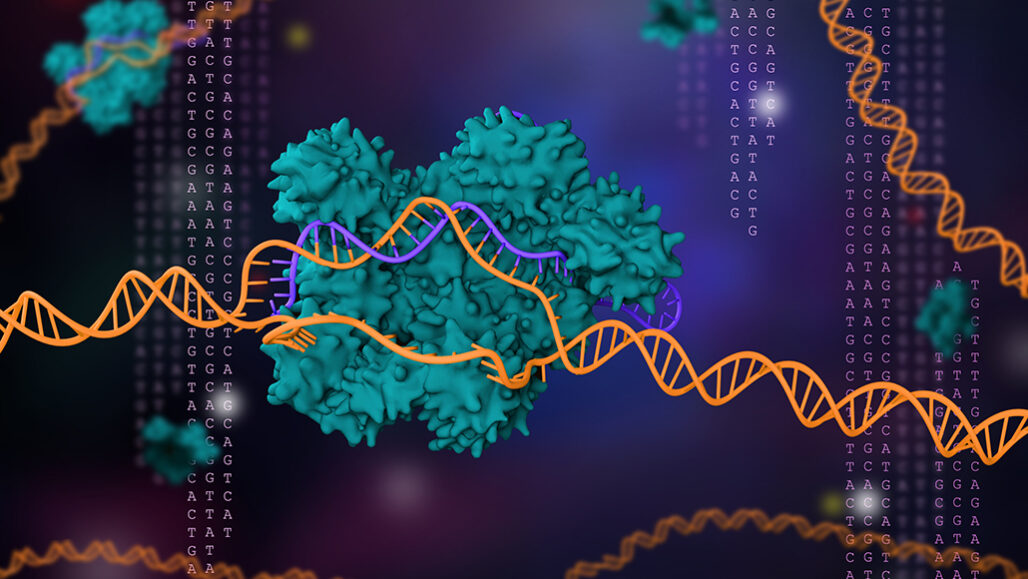
Vi khuẩn và vi khuẩn cổ (archaea) đã sử dụng CRISPR/Cas9 để chống lại virus trong hàng triệu, có lẽ hàng tỉ năm.
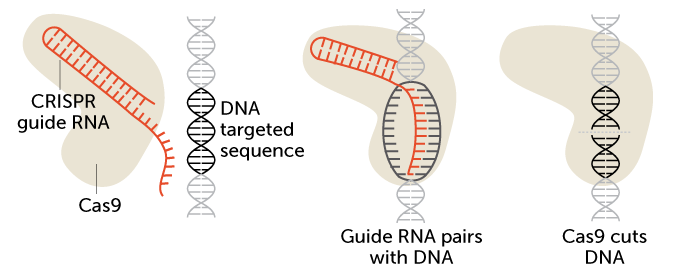
CRISPR (phát âm là crisper) được viết tắt từ cụm từ Clustered Regularly Interspaced Short Palindromic Repeats (trình tự sắp xếp kiểu lặp xuôi lặp ngược xen khoảng trống - nghĩa là những đoạn lặp nếu đọc xuôi hay đọc ngược đều giống nhau, ví dụ đơn giản nhất về từ vựng là level, madam thì ở đây là những đoạn lặp DNA gồm 21-40 nucleotide và xen giữa các đoạn lặp là các khoảng trống có độ dài từ 20-58 nucleotide - lời người dịch). Về bản chất, những đoạn ngắn lặp lại này có nhiệm vụ kẹp "phiên bản" mà vi khuẩn đặt trong danh sách muốn truy nã đó chính là virus xâm lấn. Mỗi khi vi khuẩn phải đối mặt với virus, chúng chụp hình đoạn DNA của virus và chèn mã di truyền của virus ở giữa những đoạn lặp (tức là vào phần khoảng trống - lời người dịch). Trong lần đối mặt kế tiếp với virus đó, vi khuẩn sẽ tổng hợp những bản sao mã RNA của đoạn DNA mà chúng đã chụp hình như đã nói ở trên (CRISPR RNA). Những bản sao RNA này phối hợp cùng với đoạn RNA khác được biết dưới cái tên là trans-activating CRISPR RNA (tracrRNA) (tạm dịch là đoạn RNA kích hoạt chức năng CRISPR). Tổ hợp này được gọi là RNA chỉ dẫn (guide RNA). RNA chỉ dẫn này sẽ cùng với enzyme Cas9 (một loại enzyme có chức năng cắt) tiến tới virus. Tại đây enzyme cắt và loại bỏ mối nguy cho vi khuẩn (nghĩa là khi RNA chỉ dẫn tiến tới virus, nếu nó nhận diện được vật liệu di truyền từ virus đang tấn công trùng khớp với RNA CRISPR, chúng sẽ bắt cặp với nhau. Khi đó, enzyme cas9 sẽ nhận biết vị trí cắt và cắt DNA của virus ra thành 2 đoạn nhằm vô hiệu hóa hoạt động của virus - lời người dịch).
Doudna làm việc tại Đại học California, Berkeley. Khi đó, Charpentier dứng đầu bộ môn Sinh học truyền nhiễm (Infection Biology) của viện Max Planck tại Berlin, Đức. Hai người đã gặp nhau tại hội nghị ở Puerto Rico. "Chúng tôi đã đi dạo quanh Old San Juan và nói chuyện về CRISPR/Cas9," Doudna nhớ lại trong một cuộc họp báo trực tuyến vào ngày 7 tháng 10. Hai người đã quyết định lập nhóm để nghiên cứu về cơ chế phòng vệ này của vi khuẩn. Họ đã kết thúc nghiên cứu bằng một ứng dụng là biến cơ chế phòng vệ này thành một công cụ chỉnh sửa gen (gene editor).
Sự sáng tạo của họ là tạo ra một RNA chỉ dẫn đơn, tức là biến tổ hợp CRISPR RNA - tracrRNA thành tracrRNA. Các nhà nghiên cứu nhận thấy rằng CRISPR RNA không nhất thiết phải là bản sao mã di truyền của virus. Thay vào đó, có thể thay thế mã di truyền của virus bằng một đoạn RNA mà khớp với một gen nào đó, từ đó các nhà khoa học có thể sử dụng trực tiếp enzyme Cas9 chỉnh sửa đoạn gen tương ứng đó, hoặc bất kỳ một đoạn gen nào.
Tầm quan trọng của công cụ này đã rõ ràng ngay từ đầu
Bài báo chính mà Doudna và Charpentier công bố đã được trích dẫn hơn 9500 lần. Tức là cứ 8 giờ lại có một lần trích dẫn kể từ khi nó được công bố vào năm 2012, David Liu nói. Ông ấy là một nhà sinh hóa và nghiên cứu viên của viện Y học Howard Hughes tại Đại học Harvard tại Cambridge, Mass. (Ông ấy và những người khác đã cải tiến hệ thống CRISPR nguyên thủy nhờ vậy các nhà nghiên cứu có thể ứng dụng chúng với hàng loạt cách thức mới).
Triển vọng của CRISPR ngay lập tức được nhận diện, Stanley Qi nói. Ông ấy hiện nay là nhà công nghệ sinh học và kỹ thuật sinh học tại trường Stanford, California. Ông ấy đã từng là sinh viên trong lab của Doudna. Tại đây, ông được tiếp cận với khám phá này. Và Qi cho biết từ hồi đó ông đã biết rằng CRISPR sẽ làm nên những điều vĩ đại. "Trong vòng 8 năm qua, đã có quá nhiều đột phá và những cải tiến," ông cho hay, "nó vượt xa những mong đợi của tôi".
Doudna và Charpentier "đang tiếp tục quan sát CRISPR với các enzym khác " Qi nói. Công việc mà họ đang làm đã đóng góp những hiểu biết mới về cách hệ thống này tiến hóa và hoạt động trong tự nhiên. Doudna đã cho thấy enzym Cas9 là gì và cách nó hoạt động. Ông nói, công trình của bà đã giúp các nhà khoa học khác làm cho hệ thống CRISPR chính xác hơn.
Nhiều nhà nghiên cứu hiện đã đưa những chiếc kéo di truyền này sang bước tiếp theo, sử dụng CRISPR / Cas9 để cắt và chỉnh sửa gen trong tế bào người. Các nhà khoa học say sưa nói về việc ứng dụng CRISPR rẻ và dễ dàng như thế nào. Với công cụ này, các nhà nghiên cứu đã chỉnh sửa gen ở nhiều loại động vật, bao gồm chó, chuột, ốc sên, bò sữa và muỗi.
Công cụ này cũng đã được sử dụng để mã hóa dữ liệu và lưu trữ thông tin trong DNA của vi khuẩn. Thực vật và nấm cũng đã được ứng dụng với CRISPR. Và công cụ chỉnh sửa gen này đã được sử dụng để lập trình lại các tế bào miễn dịch của con người nhằm chống lại ung thư và biến các tế bào ung thư chống lại nhau.
Chỉnh sửa hay không chỉnh sửa? Đó là một câu hỏi
Sức mạnh to lớn của CRISPR đã gây ra nhiều tranh cãi. Đó là điều mà Doudna và đồng tác giả Samuel Sternberg đã cảnh báo trong cuốn sách của họ phát hành năm 2007 có tựa đề là "A Crack in Creation: The New Power to Control Evolution". Một số người nghĩ rằng công cụ chỉnh sửa gen này có thể được ứng dụng để bảo tồn các loài có nguy cơ tuyệt chủng hoặc ngăn muỗi mang bệnh truyền nhiễm. Tuy nhiên, những nỗ lực như vậy thậm chí có thể khiến toàn bộ các loài tuyệt chủng hoặc tạo ra những thảm họa sinh thái. Thực tế, các nhà khoa học đã quét sạch những quần thể muỗi nhỏ trong phòng thí nghiệm.
Điều tranh cãi nhất là một nhà khoa học người Trung Quốc đã chỉnh sửa gen trên phôi của người. Thí nghiệm đó đã tạo ra hai bé gái song sinh vào năm 2018. Một làn sóng phản đối dữ dội đã bùng nổ. Nhiều người đã kêu gọi lệnh cấm chỉnh sửa trên trẻ sơ sinh.
Sức mạnh to lớn của CRISPR "chính là chúng ta phải sử dụng nó với sự thận trọng vô cùng" ông Claes Gustfsson cho hay. Ông là chủ tịch Hội đồng trao giải Nobel cho lĩnh vực hóa học. "Nhưng nó hoàn toàn rõ ràng rằng đây là một công nghệ...sẽ cung cấp cho loài người nhiều cơ hội lớn," ông phát biểu tại buổi họp báo ngày mùng 7 tháng 10.
Hiện tại, các thử nghiệm lâm sàng đang được tiến hành để kiểm tra khả năng ứng dụng của CRISPR/Cas9 trong việc điều trị ung thư, bệnh hồng cầu hình liềm, bệnh mù do di truyền và các bệnh khác. Nếu thành công, công cụ chỉnh sửa gen này có thể điều trị hoặc thậm chí chữa khỏi các bệnh do di truyền mà không thể điều trị trước đây. CRISPR thậm chí còn đóng một vai trò trong đại dịch coronavirus. Một số xét nghiệm chẩn đoán COVID-19 và các liệu pháp đang được phát triển dựa trên công nghệ CRISPR.
Ngoài Doudna và Charpentier, cho đến nay chỉ có năm người phụ nữ từng đoạt giải Nobel hóa học. Doudna nói: "Tôi nghĩ rằng đối với nhiều phụ nữ, có cảm giác rằng công việc của họ sẽ không bao giờ được công nhận trừ khi họ là đàn ông. Tôi muốn thấy sự thay đổi đó, và tôi tin rằng đây là một bước đi đúng hướng."

Khoa học - Công nghệ
/khoa-hoc-cong-nghe
Bài viết nổi bật khác
- Hot nhất
- Mới nhất